Système décisionnel pour le traitement antibiotique de la mammite en lactation basé sur les résultats de Petrifilm™
Outil rapide d’identification à la ferme des bactéries causant la mammite
La mammite est la cause première de l’utilisation des antibiotiques sur les fermes laitières. Différents types de bactéries peuvent infecter le pis. Certaines d’entre elles ont des taux élevés d’autoguérison ou répondent mal aux traitements. Il est important de bien les identifier pour aider le producteur et son médecin vétérinaire à cibler le traitement à administrer, s’il y a lieu, sans toutefois nuire ou retarder la guérison.

Avantages
- Permet de mieux cibler les cas causés par des bactéries Gram + (donc à traiter)
- Identification des bactéries plus rapide que la culture bactériologique en laboratoire (sans pour autant la remplacer)
- Usage plus rationnel des antibiotiques
- Réduction des pertes de lait
- Diminution des risques de résidus d’antibiotiques dans le lait
Limites
-
Minutie requise pour réaliser la technique en évitant la contamination
-
Interprétation influencée par l’expérience et la formation de l’usager
-
Identification impossible des mycoplasmes et des levures (dont le traitement n’est pas recommandé)
Une technique de coloration en laboratoire permet de classifier la plupart des bactéries en deux catégories :
Bactéries Gram positif
-
Principalement des staphylocoques et des streptocoques
-
Paroi cellulaire mince
Exemples de Gram positif
-
Staphylococcus aureus
-
Staphylococcus spp.
-
Streptococcus uberis
-
Streptococcus dysgalactiae
-
Streptococcus agalactiae
-
Corynebacterium bovis
Bactéries Gram négatif
-
Principalement des coliformes
-
Paroi cellulaire très épaisse qui protège des effets de la plupart des antibiotiques, détergents et produits chimiques
-
Contiennent des lipopolysaccharides toxiques
-
Ne répondent pas bien aux traitements antibiotiques
Exemples de Gram négatif
- Escherichia coli
- Klebsiella spp.
- Enterobacter spp.
- Serratia spp.
- Pasteurella spp.
Matériel nécessaire
À la ferme, à la maison ou à la clinique vétérinaire, installez le « laboratoire » dans un endroit propre et sec pour éviter la contamination.
Plaques Petrifilm™ pour numération des coliformes (GRAM –) cercle rouge avec styromousse portant le code CC
Photo

Photo

Plaques Petrifilm™ Staph Express (staphylocoques) : cercle blanc avec styromousse portant le code STX et disque mauve Staph Express (optionnel pour la détection de Staph. aureus)
Photo
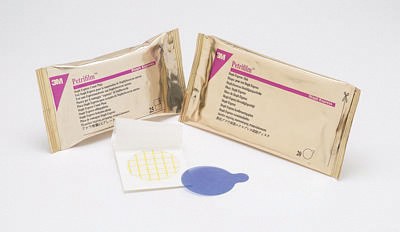
Étaleur (surface striée et surface lisse)
Étaleur pour Staph Express (rond et plat)
Seringues 3ml, 10ml et Aiguilles 1 1/2 pouce
Flacons ou tubes stériles d’échantillonnage
Bouteille d’eau stérile (eau physiologique 0,9 % NaCl ou tampon phosphate)
Tampons de gaze imbibés d’alcool
Incubateur
(L’incubateur recommandé est le Turbofan Hova-Bator modèle 1602, disponible auprès de votre magasin local de fournitures agricoles ou consultez internet pour connaître le point de vente le plus près.)
Gants pour usage unique
Crayon marqueur
Entreposage et manutention des plaques
Éviter la salle de traite et la laiterie (humidité élevée)
Conserver les plaques au réfrigérateur dans leur emballage scellé. Les plaques non scellées doivent être congelées. Respecter la date de péremption.
Ne pas exposer à la lumière du soleil et jeter toute plaque décolorée
Ne pas toucher à la surface de la plaque
MISE EN GARDE
- Le système de culture à la ferme doit être utilisé pour des cas légers ou modérés de mammite (grade 1 ou 2) sans présence de fièvre (< 39,5 °C) ou de maladies graves.
- Il est essentiel d’élaborer un protocole d’échantillonnage et un protocole de traitement associés à l’utilisation de ce système avec votre médecin vétérinaire.
- Si les symptômes cliniques s’aggravent, prenez immédiatement des mesures et consultez votre médecin vétérinaire.
Pour Commander
Le système décisionnel pour le traitement de la mammite est disponible en format trousse contenant tout le matériel requis, à l’exception des plaques Petrifilm™ Staph Express, les disques mauves et l’étaleur pour Staph Express.
Pour commander la Trousse de MQM, contacter :
- Votre médecin vétérinaire
- Maritime Quality Milk
Pour commander directement les produits PetrifilmMC ou pour consulter un représentant, veuillez contacter innovation Diagnostics, Inc.

Protocole d’inoculation des Petrifilm AC

Étape 1
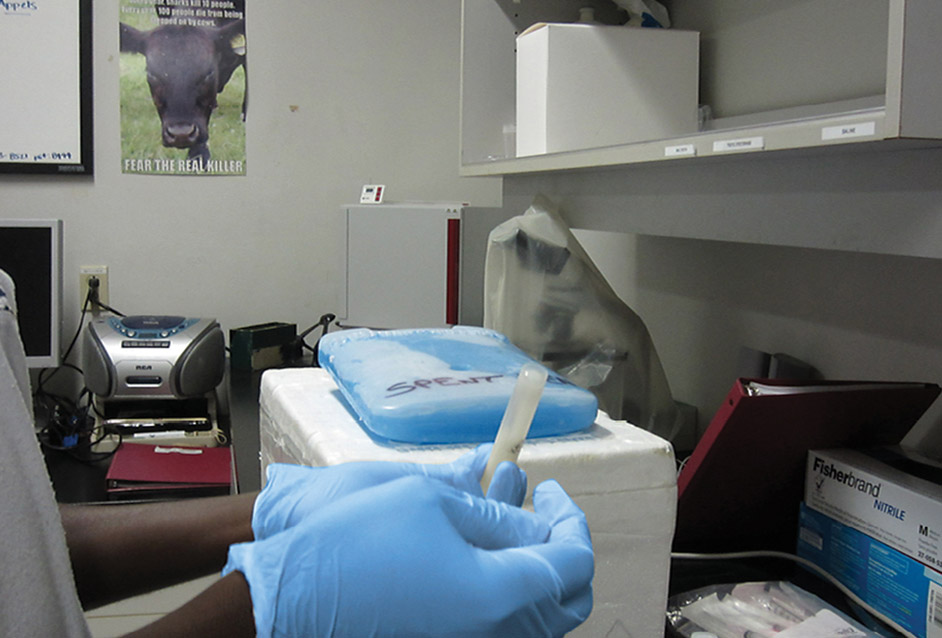
Prélever 9 ml d’eau stérile et les mettre dans un tube stérile. Ne pas toucher l’intérieur du tube et du bouchon avec la seringue ou les doigts.
Étape 4
Homogénéiser : Fermer le tube puis agiter le tube de lait dilué en le basculant de haut en bas au moins 5 fois.

Étape 7
Relâcher le film supérieur. Déposer l’applicateur au-dessus du film supérieur (côté circulaire vers le bas) et y appliquer une légère pression pour distribuer l’échantillon sur la zone circulaire.
Crédits images: 3M
Étape 2
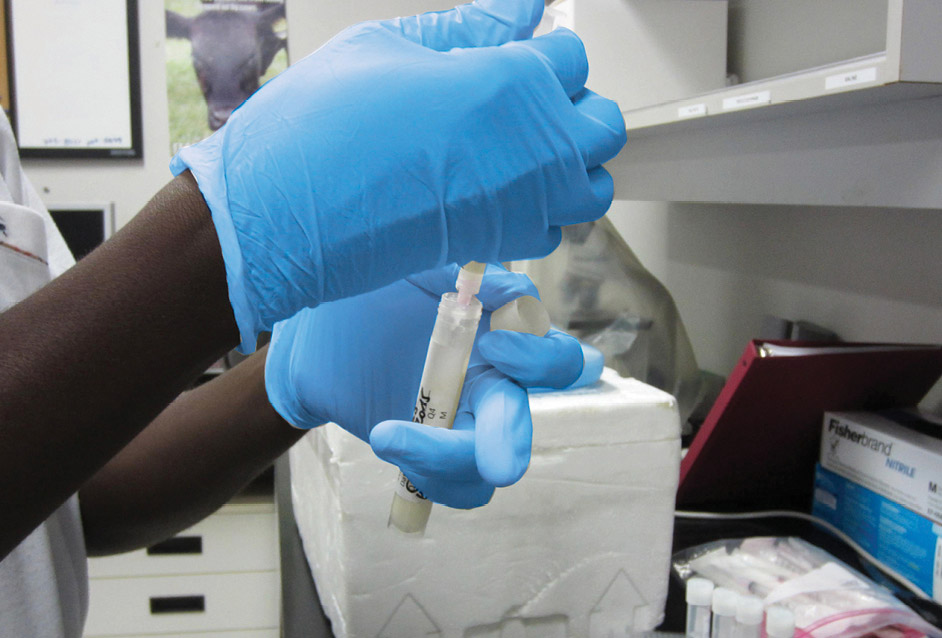
Prélever 1 ml de l’échantillon de lait.
Étape 5
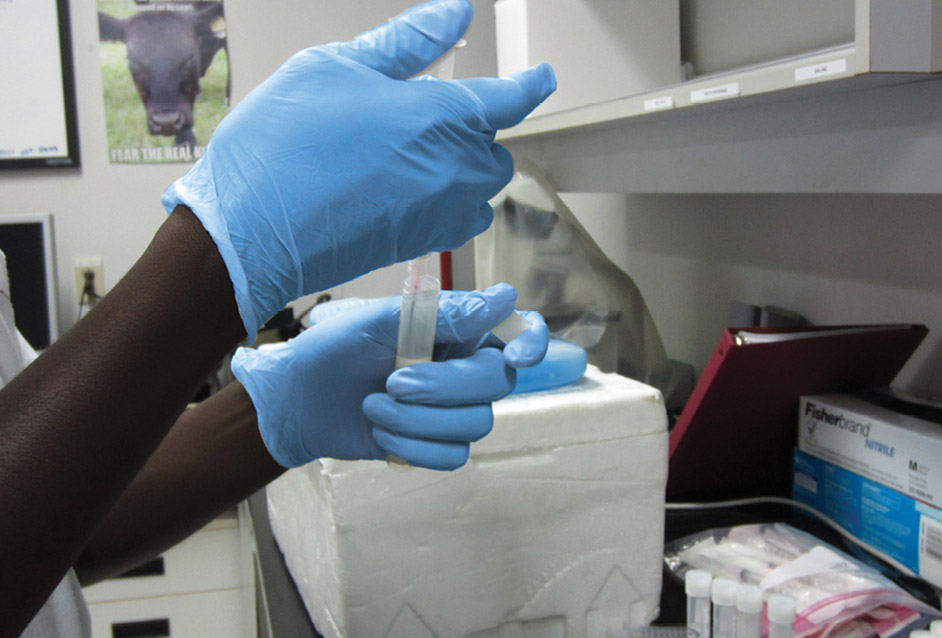
Prélever 1 ml de lait dilué à l’aide de la seringue utilisée précédemment. Aspirer et remettre le lait dilué une fois, afin de rincer la seringue.

Étape 8
Mettre les Petrifilm à l’incubateur à 35 ° C pendant 24 heures. Assurez-vous qu’ils contiennent un peu d’eau pour maintenir une légère humidité.
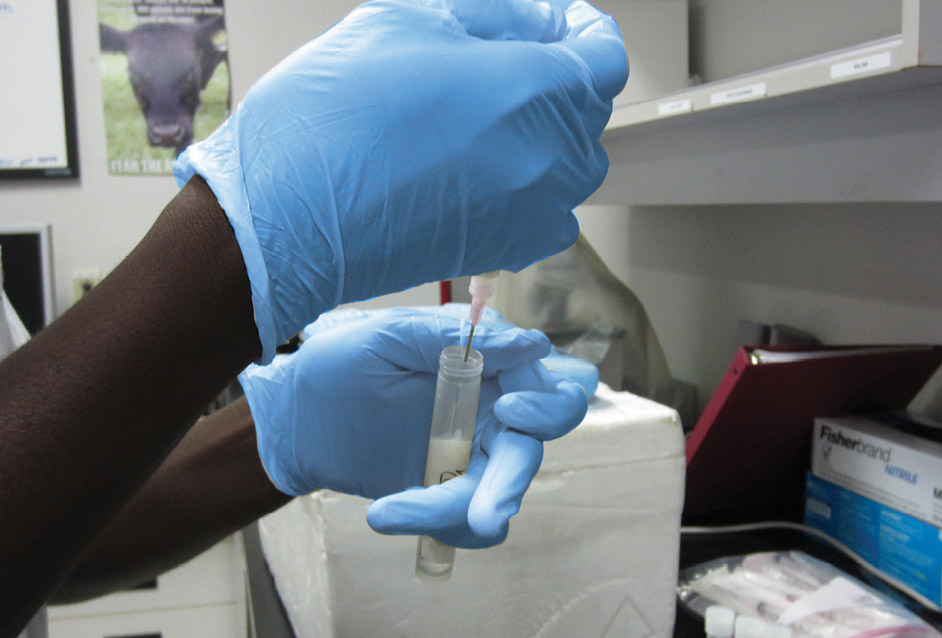
Étape 3
Mettre 1 ml de lait dans un tube contenant 9 ml d’eau stérile (dilution 1:10).

Étape 6
Placer la plaque de Petrifilm préalablement identifiée (vache, quartier, date et heure) sur une surface plane, soulever le film supérieur, puis placer 1 ml de lait dilué au centre du film inférieur sans le toucher avec la seringue ou les doigts.
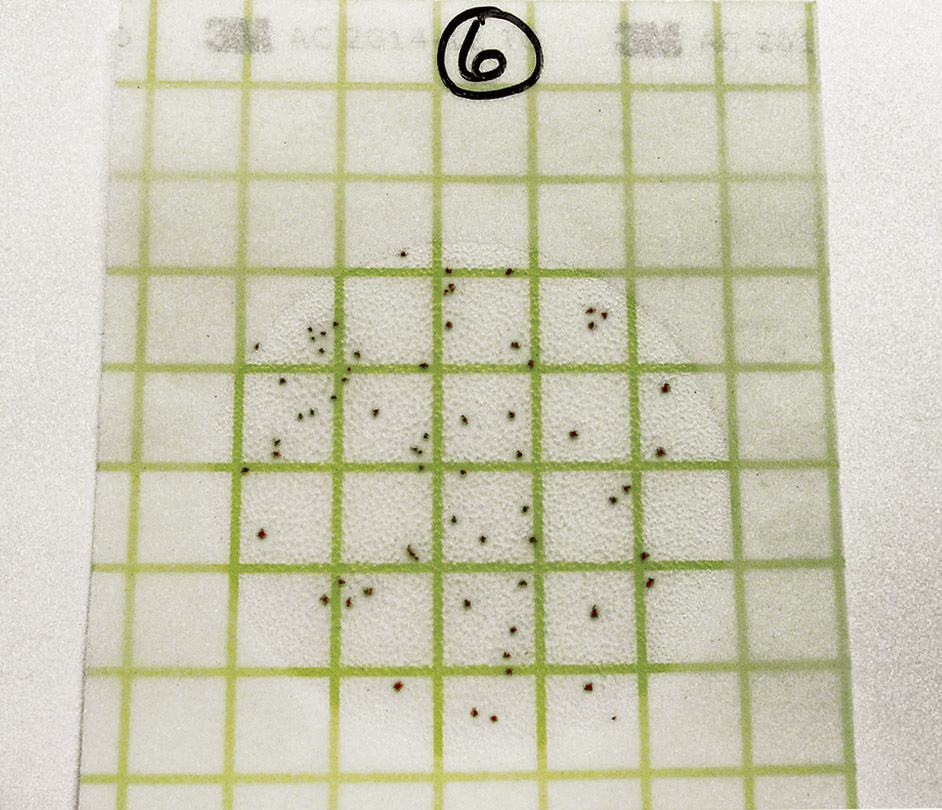
Étape 9
Procéder à la lecture des résultats sur le Petrifilm. Chaque point représente une colonie bactérienne. Compter l’ensemble de la plaque, pas seulement un carré. Noter les résultats dans vos dossiers.
Protocole d’inoculation des Petrifilm CC

Étape 1
Prélever 9 ml d’eau stérile et les mettre dans un tube stérile. Ne pas toucher l’intérieur du tube et du bouchon avec la seringue ou les doigts.

Étape 4
Homogénéiser : Fermer le tube puis agiter le tube de lait dilué en le basculant de haut en bas au moins 5 fois.
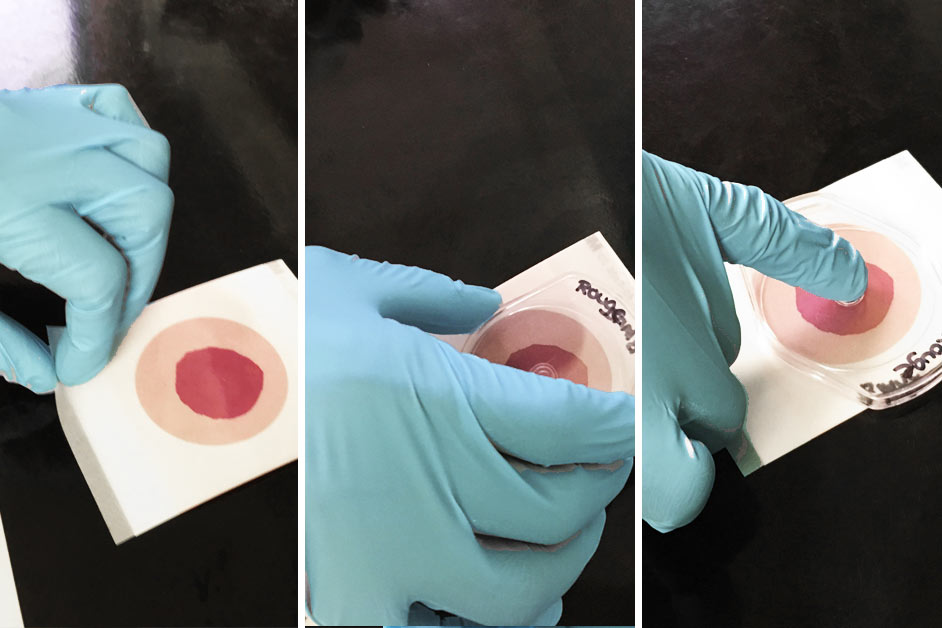
Étape 7
Relâchez le film supérieur. Déposer l’applicateur au-dessus du film supérieur (côté circulaire vers le bas) et y appliquer une légère pression pour distribuer l’échantillon sur la zone circulaire.
Crédits images: 3M

Étape 2
Prélever 1 ml de l’échantillon de lait.

Étape 5
Prélever 1 ml de lait dilué à l’aide de la seringue utilisée précédemment. Aspirer et remettre le lait dilué une fois, afin de rincer la seringue.

Étape 8
Mettre les Petrifilm à l’incubateur à 35 ° C pendant 24 heures. Assurez-vous qu’il contienne un peu d’eau pour maintenir une légère humidité.

Étape 3
Mettre 1 ml de lait dans un tube contenant 9 ml d’eau stérile (dilution 1:10).

Étape 6
Placer la plaque de Petrifilm préalablement identifiée (vache, quartier, date et heure) sur une surface plane, soulever le film supérieur, puis placer 1 ml de lait dilué au centre du film inférieur sans le toucher avec la seringue ou les doigts.

Étape 9
Procéder à la lecture des résultats sur le Petrifilm. Chaque point représente une colonie bactérienne. Compter l’ensemble de la plaque, pas seulement un carré. Noter les résultats dans vos dossiers.
Protocole d’inoculation des Petrifilm STX

Étape 1
Prélever 9 ml d’eau stérile et les mettre dans un tube stérile. Ne pas toucher l’intérieur du tube et du bouchon avec la seringue ou les doigts.

Étape 4
Homogénéiser : Fermer le tube puis agiter le tube de lait dilué en le basculant de haut en bas au moins 5 fois.

Étape 7
Relâchez le film supérieur. Déposer l’applicateur au-dessus du film supérieur (côté circulaire vers le bas) et y appliquer une légère pression pour distribuer l’échantillon sur la zone circulaire.
Crédits images: 3M

Étape 2
Prélever 1 ml de l’échantillon de lait.

Étape 5
Prélever 1 ml de lait dilué à l’aide de la seringue utilisée précédemment. Aspirer et remettre le lait dilué une fois, afin de rincer la seringue.

Étape 8
Assurez-vous que l’incubateur contienne un peu d’eau pour maintenir une légère humidité.

Étape 3
Mettre 1 ml de lait dans un tube contenant 9 ml d’eau stérile (dilution 1:10).

Étape 6
Placer la plaque de Petrifilm préalablement identifiée (vache, quartier, date et heure) sur une surface plane, soulever le film supérieur, puis placer 1 ml de lait dilué au centre du film inférieur sans le toucher avec la seringue ou les doigts.
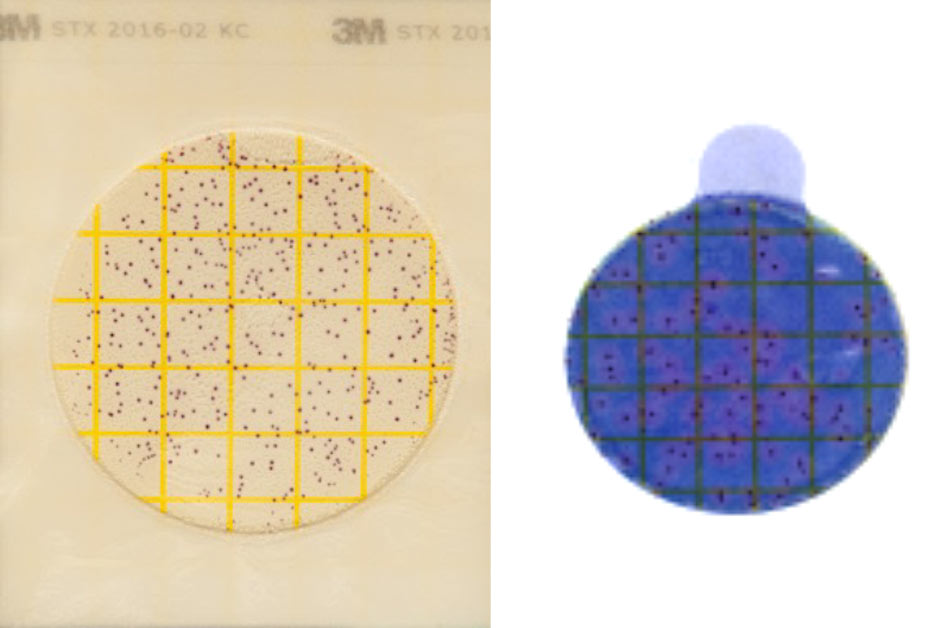
Étape 9
Interprétation des résultats (AC et STX)
L’interprétation des résultats peut nécessiter l’assistance d’un médecin vétérinaire pour confirmer le diagnostic.
Établissez également avec lui un protocole de traitement approprié selon les résultats obtenus.
La catégorisation en Gram positif, Gram négatif et Aucune croissance peut être réalisée grâce aux plaques AC et CC. Un guide d’interprétation est disponible sur www.milkquality.ca
Pour les cultures Staph Express (STX) positives et confirmées par le disque mauve, traitez ces cas selon les directives de votre médecin vétérinaire.
